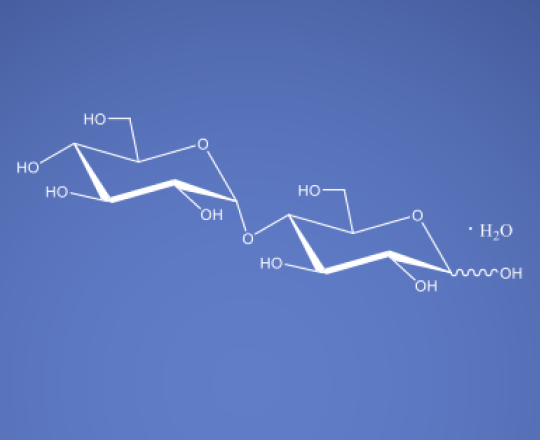
Pfanstiehl Maltose-Monohydrat-Zitierseite
Menü
Menü
- Startseite
- Lösungen
- Impfstoff & biologische Stabilisierung
- Reduzierung der Proteinaggregation
- Reduzierung der Viskosität
- Hochkonzentrierte Formulierungen
- Minderung des Polysorbatabbaus
- Biologische Formulierungen für die Inhalation
- Bispezifische und trispezifische Antikörperformulierungen
- Komplexe Lösungen für die Chemie
- Niedrige Metalle Hilfsstoffe
- Niedrige Nitrosamin-Hilfsstoffe
- Produkte
- Dienste
- Publikationen
- Über uns
- Nachrichten
- Kontaktieren Sie uns